美国食品和药物管理局(FDA)已同意审查一种用于治疗成人活动性类风湿关节炎的疗法的生物制剂许可证申请(BLA)。
美国食品和药物管理局(FDA)已同意审查一种用于治疗成人活动性类风湿关节炎的疗法的生物制剂许可证申请(BLA)。
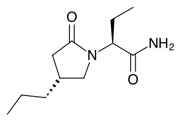
Cimzia (certolizumab pegol)是由比利时生物制药公司UBC开发的一种研究性药物。
如果获得批准,这将是首个也是唯一一个用于治疗类风湿性关节炎的聚乙二醇化抗tnf(肿瘤坏死因子)生物疗法。
UCB炎症手术总裁Olav Hellebo说:“作为一种新的抗tnf,我们相信Cimzia将为患有这种疾病的人提供一种重要的新选择。”
BLA基于超过2367名患者的数据,包括三个多中心安慰剂对照III期试验,这些试验在美国风湿病学会(ACR)年度科学会议上发表。
在这些研究中,Cimzia联合甲氨蝶呤被证明在活动性RA患者24周(RAPID 1和RAPID 2)早期抑制关节损伤进展方面比甲氨蝶呤单独有效得多。
Cimzia可迅速减轻活动性RA的体征和症状,在14周和16周时达到ACR50和70的峰值。身体功能和生活质量的改善也持续了一年(RAPID 1)。此外,Cimzia单药治疗从第1周开始就显示出RA症状和体征的显著改善,并一直持续到第24周(Study 011)。最常见的不良反应为头痛、鼻咽炎和上呼吸道感染。报告的严重不良反应为感染(包括结核病)和恶性肿瘤(包括淋巴瘤),这与抗tnf类其他试验的结果一致。
目前正在准备向欧洲药品管理局(EMEA)提交Cimzia治疗RA的上市许可申请(MAA)。计划在今年上半年提交申请。

2007年9月,Cimzia在瑞士被批准用于治疗克罗恩病。该疗法于2008年1月推出。