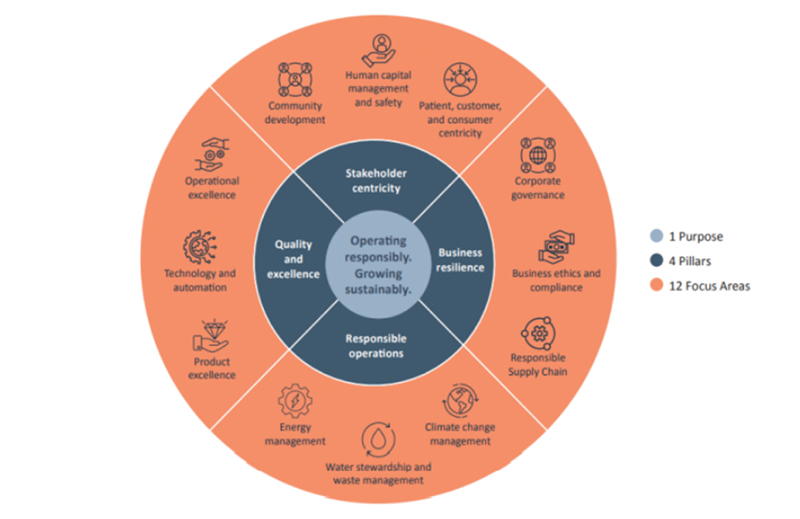
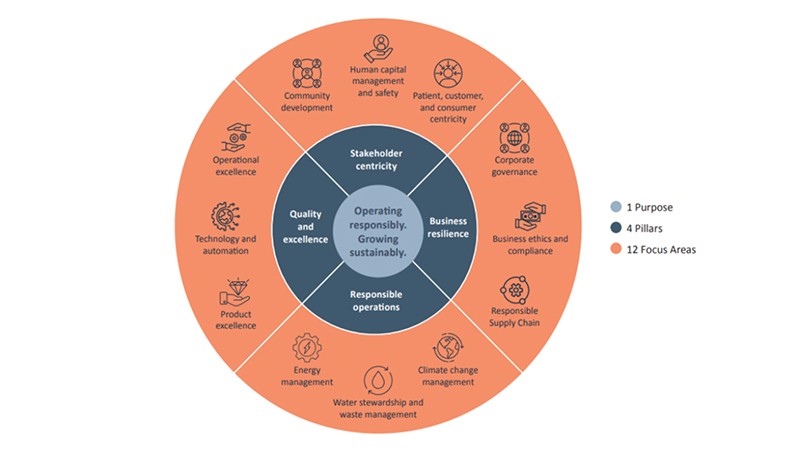
Piramal Pharma Solutions是一家CDMO,提供横跨药物生命周期的端到端开发和制造解决方案。皮拉马尔的监管事务主管Minoo Biju在这里探讨了企业如何建立成功的监管合作伙伴关系

CDMO在制定和最终确定监管文件中的CMC部分方面发挥着关键作用。CDMO经验丰富且技术健全的监管团队是确保各种监管机构快速无缝批准产品的宝贵合作伙伴。
CDMO意识到设计质量(QbD)在产品和过程开发中的重要作用是至关重要的。CDMO的监管团队很好地为开发团队提供输入,以确保产品和工艺开发遵循QbD原则。即使产品开发是由客户完成的,CDMO也拥有来自他们为客户开发的大量产品的设备和工艺的第一手知识。这是有助于确定技术转让业务成功与否的一个关键因素。
如药物开发ICH Q8 (R2)中所述,QbD需要考虑的基本方面如下:
根据上述QbD原则开发的产品和工艺有更大的机会获得成功注册和快速批准流程。
监管小组的专门知识和经验受到高度重视的另一项活动是在起草规范期间提供的投入。
在设计规格时,测试和限制应基于ICH指南。原料药和制剂中除了有机和无机杂质限值外,还应监测和控制基因毒性杂质、元素杂质和亚硝胺杂质等其他杂质。亚硝胺杂质最近引起了世界各地监管机构的广泛关注。
一支经验丰富、技术娴熟、了解最新监管发展和指导方针的监管团队,将是确保满足上述要求不可或缺的资产。
CTD模块3的大部分文档由CDMO提供。这些信息包括组件和成分、批配方、制造工艺、规格、分析方法验证、包装组件信息、稳定性数据、执行和商业批记录、分析证书等。
有了这些知识,CDMO的监管团队就可以很好地编写模块3的摘要,即质量总体摘要(QOS)。
除了CMC的审查和编制,CDMO的监管团队可以帮助取得注册成功的一个同样重要的作用是档案的电子发布,即eCTD发布。这一活动通常由没有配备内部eCTD出版团队的小型制药公司外包。CDMO的监管团队可以介入并帮助填补这一空白。由于他们已经参与了档案中CMC部分的审查和编写,eCTD的出版将是这种合作的另一个步骤,对双方组织都有利。
因此,CDMO和客户之间建立的有效监管伙伴关系可以通过利用其内置的效率,导致成功的监管备案和更快的批准。一个经验丰富、效率高的CDMO监管团队可以缩短审查和编制的时间,因为他们有直接参与产品和工艺设计的优势,并且对他们生产的类似产品有了解。这有助于更快地响应卫生当局的询问,从而加快产品批准和上市速度。