对于临床试验中的每个样本,审计追踪可以扩展到数千个条目,这使得数据记录成为一项挑战。在英国,利物浦癌症试验单位决定用一种更有效的系统取代其论文记录——威廉·格林哈夫博士和约翰·布瑟博士描述了他们是如何做到的

为了维护临床试验参与者的安全和权利,并确保临床试验产生的数据的可靠性和稳健性受到严格监管。在欧盟,相关法规为欧盟临床试验指令(2000 /20/EC和2005/28/EC)。新的欧盟临床试验条例已于2014年4月由欧洲议会批准,预计将于2016年成为整个欧盟的法律。
在英国,由此产生的法规的执行授权给药品和保健产品监管机构(MHRA),该机构有权检查所有记录,并逮捕任何被认为可能违反英国法律(或欧盟法规)的个人。MHRA已经发布了对临床试验样本进行分析和评估的实验室保持合规性的指南。1遵守实验室的良好临床实践(GCP)指南使临床实验室能够确保数据的安全性和有效性,并且数据是可重复的、可靠的、可审计的,并且可以在研究环境中轻松地重建和审计。
根据欧盟委员会公共卫生部门的数据,欧盟大约40%的临床试验是由学术界、基金会、医院或研究网络(通常被称为“非商业赞助商”)进行的。2在英国,实验癌症医学中心(ecmc)是在英国政府通过国家健康研究所和英国慈善机构英国癌症研究中心的联合倡议下建立的。其目的是为任何旨在治愈或缓解癌症的临床试验提供实验室支持。2007年,利物浦获得ECMC资格。利物浦ECMC与利物浦癌症试验单位(LCTU)合作,LCTU也由英国癌症研究中心资助,负责协调国家和国际癌症试验。
包括利物浦在内的许多ecmc都建立了GCP实验室设施。利物浦GCLP工厂收集、存储和分析来自试验的样品,所有可能对试验结果评估产生影响的样品都受立法管辖,并应接受MHRA的检查。
虽然利物浦GCLP工厂最初使用的纸质记录系统和计算机环境监测系统符合所有监管要求,但任何对纸质记录的内部审计都可能需要几个月的时间,而且费用高昂。挑战在于找到一种替代纸质记录的方法,既具有成本效益,又能接受外部检查,并提供透明的审计追踪。
挑战在于找到一种替代纸质记录的方法,既具有成本效益,又能接受外部检查,并提供透明的审计追踪
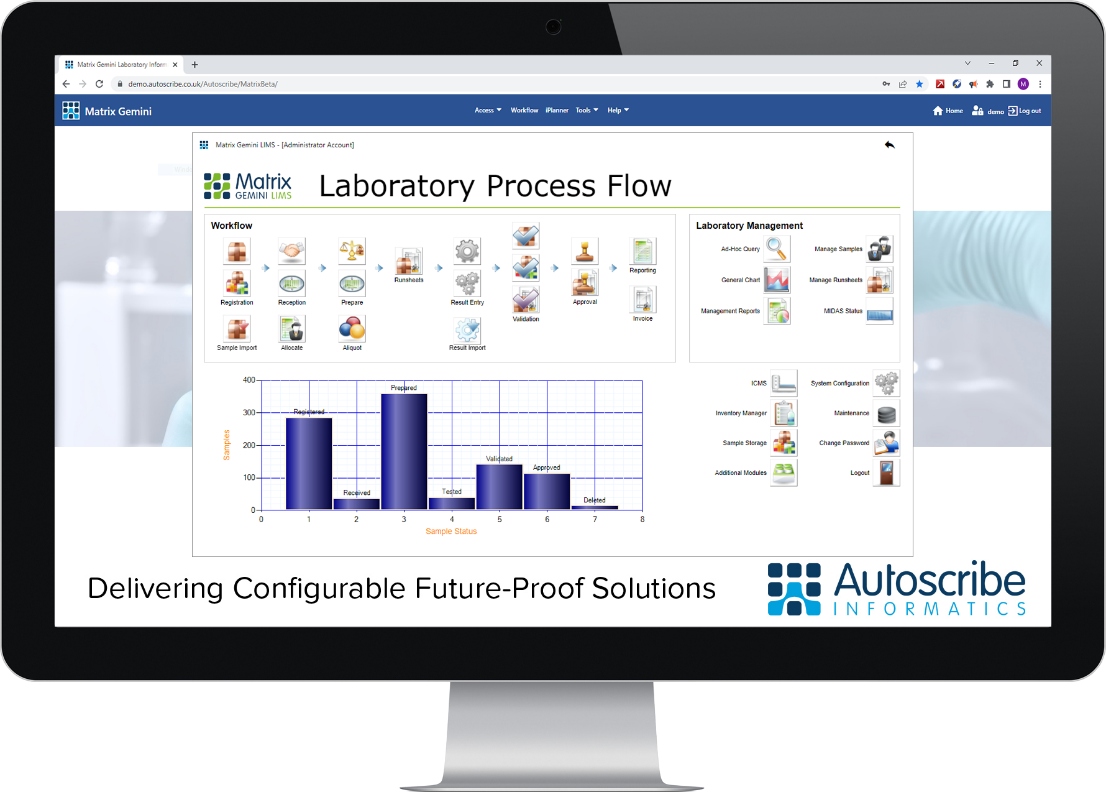
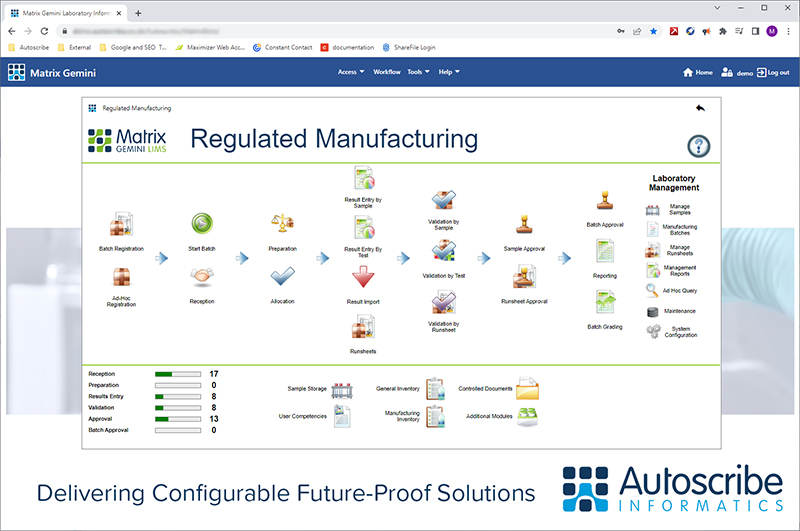
现代实验室信息管理系统(LIMS)能够跟踪临床试验收集包/用品,管理和跟踪标本,管理实验室检测工作流程和记录质量表现,创建实验室报告和管理研究特定文件,利物浦GCLP设施与LIMS的开发商Autoscribe合作,建立了一个系统,以满足临床试验的严格要求。Autoscribe的Matrix Gemini LIMS使用其OneTime配置工具配置,以记录每个试验工作流中的每个步骤,并以易于访问的格式存储日志,允许在几分钟而不是几天内进行审计。
Matrix Gemini解决方案是FDA CFR21 Part 11-ready,允许创建和更新Microsoft SQL server数据库,并从LIMS的工作流中添加每个样本的审计点,模拟试验中使用的湿实验室流程。
由于湿法实验室的工作流程依赖于试剂盒的制造,包括样品收集、处理和存储所需的所有组件,因此每个研究试剂盒都是建立的在网上在实验室制造的同时。每个工具包都被记录到密码保护的结构化查询语言(SQL)服务器数据库上的批处理表中,工具包的每个组件都被记录到示例表中。工具包必须制造在网上在工具包的标签可以打印之前。检测前必须对试剂盒的每个组件进行质量控制(确认其存在于试剂盒中并正确贴上标签)在网上工具包可以存储或发送到现场。

标签的印刷是连接虚拟世界和现实世界的纽带。如果LIMS上的步骤没有完成,就不会有任何标签贴在管子上
试剂盒组件上的标签允许患者完全匿名,但提供了实验室和临床数据之间的联系。他们还提供了从研究数据到患者同意书的审计跟踪,显示数据是否合法收集,是否无视试验结果,是否符合患者的意愿。这可以在不损害患者保密的情况下实现。当LCTU收到传真表时,将生成一个患者代码,将试剂盒与临床详细信息链接起来,该代码将传递给GCLP设施并登录到LIMS上。当样品在GCLP工厂接收时,在LIMS上记录时间,并输入将用于样品直接处理的试剂的批号。
离心步骤必须完成在网上,与样品的湿实验室处理并行。所使用的特定仪器的代码被记录下来;这可以与机器的服务记录相匹配,这也记录在LIMS上。
样品的任何样本都记录在LIMS上,为每个样本生成新的样本代码,这些代码用于从LIMS打印的标签上。aliquot的数据库记录携带父样本的代码,任何样本的组合也通过生成一个新的样本代码和更新父样本记录以包括子样本的代码来记录。通过这种方式产生审计跟踪,允许任何样本追溯到其原始试剂盒组件,从而追溯到患者代码和(通过LCTU)患者同意书。
对样品进行的任何分析都与LIMS上定义的“测试”相匹配,LIMS记录了标准操作程序中的每个步骤,并给出了可以与样品结果表中输入的测试结果相匹配的测试组件。
每个样品的存储记录为一个特定的预定义位置,不能选择在同一位置存储多个活动样品
测试数据的输入可以手动完成,但更常见的是通过逗号分隔值(CSV)文件,该文件允许数据以表格格式保存,并由分析中使用的设备生成。CSV文件将与分析机器上的数据文件相匹配,可以检查该数据文件以确认数据输入是数据生成的真实表示。
每个样品的存储记录为一个特定的预定义位置,不能选择在同一位置存储多个活性样品(例如,由冷冻室名称、冷冻室抽屉、抽屉中的盒子和盒子内的坐标组成的唯一代码)。当在网上工作流要求从释放的位置移除样本,但显然保留了原始占用的记录,再次允许完整的审计跟踪。

利物浦癌症试验单位
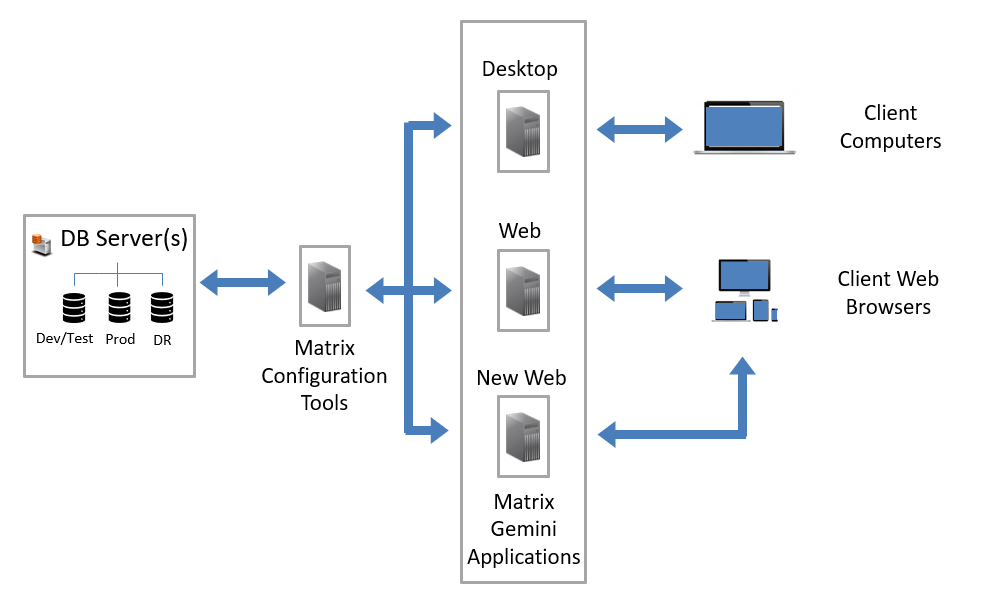
Matrix Gemini完全由非分层密码访问控制,显示谁进行了每个条目,并限制访问系统中适合每个用户的那些区域。LIMS提供审计工具,以保证输入的所有数据的质量。上的每个条目都可用SQL数据库进行检查在网上试剂盒准备,运输,样品接收,加工,储存和测试。这些记录可以与选定的实验室账簿条目和设备记录相匹配。此外,OneTime配置工具提供的灵活性意味着,如果将来对官方法规进行任何更改,可以随时修改系统。
利物浦大学被授予英国第二所获得早期临床试验认证的学术机构的地位
经过包括Matrix Gemini在内的MHRA的检查,利物浦被授予英国第二家获得早期临床试验认证的学术机构的地位。在这一认证的基础上,利物浦吸引了由诺华、勃林格、默克、Kael GemVax和包括英国癌症研究在内的各种慈善机构资助的国家和国际临床试验。
Matrix Gemini提供的试验从第一阶段到第三阶段。2007年至2011年间,欧盟进行的临床试验数量下降了25%1然而,尽管在试验活动总体减少的背景下,自采用矩阵解决方案以来,利物浦临床试验的营业额增加了三倍。
1.www.mhra.gov.uk Howweregulate /药品/ Inspectionandstandards / GoodClinicalPractice / GoodClinicalPracticeGuide /你
2.http://ec.europa.eu/health/files/clinicaltrials/2012_07/press-releases/memo-12-566_en.pdf
Bill Greenhalf博士是利物浦GCLP设施的运营总监和利物浦大学的读者。
John Boother是Autoscribe的董事总经理